Найден препарат, позволяющий ранам заживать без шрамов
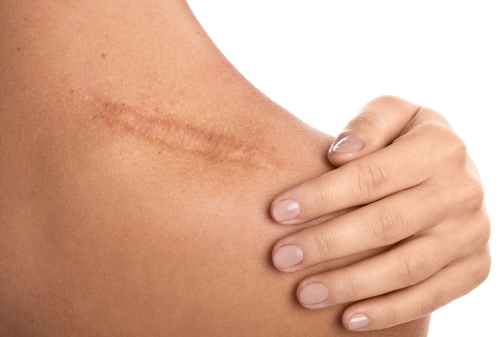
Простой вопрос от научного руководителя - Почему после травм или операций появляются шрамы? - отправил Майкла Лонгакера в путешествие за ответом, продолжавшееся 34 года.
Теперь хирург из Медицинской Школы Стэнфорда с коллегами нашли его. Они также обнаружили, что воздействие определенных веществ в процессе заживления производит ткань, неотличимую от нормальной кожи.
Статья с открытием ученых вышла в журнале Science 23 апреля.
«Почти у каждого человека есть шрамы. По оценкам Лонгакера каждый год в одних тоглько США и только от хирургических операций появляется от 50 до 80 новых шрамов. Гораздо больше - от травм. Появление шрамов - это далеко не только косметическая проблема: рубцовая ткань не содержит волосянных фолликул и потовых желез, менее упругая и менее прочная. Шрамы могут ограничивать способность наших тел двигаться и адаптироваться к изменениям температуры».

Поиск Лонгакера начался в 1987 году, когда он был в постдокторантуре Университета Калифорнии. Он также работал в лаборатории хирурга Майкла Харрисона, который проводил операции еще нероржденынм младенцам в случае угрозы их жазни. Харрисон попросил Лонгакера исследовать, почему от ран на коже плода не остается шрамов, хотя они остаются у детей и взрослых. "Эта задача заняла меня на год, который превратился в четыре года, а потом в десятилетия. С тех пор поле моей деятельности расширилось во многие другие области, но попытки понять, почему формируются шрамы, всегда составляли мой интерес."

Шрамы появляются потому, что могут залечить повреждение кожи намного быстрее обычной ткани. "Если ваши раны залечиваются медленно, вы можете подхватить инфекцию или истечь кровью до смерти. Шрамы - это точечная сварка, они покрывают рану быстро, но нарушают внешний вид и функциональность." В зависимости от места, шрамы могут мешать сгибать руку в локте, закрывать глаза или открывать рот.

Гюнтер и Лонгакер нашли, что натяжение во время заживления раны играло критическую роль в рубцевании. Лонгакер наблюдал, как натяжение меняло заживление хирургических ран. "Во врвемя внутриутробного развития, когда повреждение кожи не выцывает рубцевания, кожа плода желатинообразна и не обладает "тугостью" привычной нам кожи. В противоположность, когда нам 95, когда наша кожа подвергалась воздействию солнечных лучей, она более дряблая, то рубцевание минимально потому что кожа недостаточно упруга." Лонгакер и Гюнтер показали, что если ослабить силы, стягивающие края раны, рубцевание может быть снижено.
Но почему натяжение кожи во время заживления приводит к рубцеванию? Лонгакер и Гюнтер сфокусировались на гене Engrailed Этот ген помогает создавать белки, находящиеся в фибробластах, клетках кожи, приводящих к рубцеванию.
В серии экспериментов на мышах они открыли субпопуляцию фибробластов, которые начинают экпрессировать Engrailed во время заживления раны, хотя обычно этого не делают.
Далее они изучали роль механического воздействия на активность гена. Клетки могут чувствовать механическое давление с помощью хорошо изученных механизмов, и существуют способы блокировать эту их чувствительность. Исследователи взяли фибробласты мышей, которые не экспрессировали Engrailed и вырастили их в лаборатории в трех различных типах условий: внутри мягкого геля, который не производил механического натяжения в растущих фибробластах; в пластиковой чашке с натяжением; и в такой же чашке, но с добавлением вещества, блокирующего сигналы о натяжении.

Они обнаружили, что фибробласты, выросшие в геле не начали экспрессировать Engrailed. У клеток, выросших в чашке, ген включался. Но у клеток из пластиковых чашек с добавлением блокатора - нет.
Когда натяжение было приложено к ранам мышей после операций, то возросло количество клеток с активным геном и образовывался более толстый рубец.
Исследователи нашли препарат, вертепорфин, который одобрен FDA для лечения заболеваний глаз путем блокирования сигналов о механическом давлении. Ученые нанесли хирургические раны мышам под анестезией и применили механическое натяжение к ранам одновременно вводя в них вертепорфин.

"Результаты были потрясающими," - говорит Лонгакер. Зажившая кожа выглядела совершенно нормально. Есть три критерия, чтобы считать регенерацию кожи полноценной: должны быть волосяные фолликулы и железы, кожа должна нормально выглядеть под микроскопом, и должна быть такой же прочной, как обычная.
Исследователи добились всех трех критериев в эксперименте. Они даже создали искусственный интеллект, который сравнивал макроснимки кожи, чтобы увидеть малейшие отличия, которые не может заметить человек. Алгоритм оказался неспособен отличить обычную кожу от регенерированной с помощью вертепорфина.
Помимо заживления ран, у препарата может быть много других применений: фиброз печени, ожоги, склеродерма, рубцевание сердечной ткани после инфарктов и т. д. Примерно 45% американцев умирают от заболеваний, включающих в той или иной мере рубцевание.
Следующий этап - испытания на других животных и, в случае успеха, клинические испытания на людях.

http://med.stanford.edu/news/all-news/2021/04/drug-enables-healing-without-scarring.html
https://science.sciencemag.org/content/372/6540/346.summary
Имя *:
Комментарий *:




